|
오존에 대하여
1. 오존의 개론
1.1 오존은 산소원자 세개로 구성된 기체(산소의 동위체, 분자기호 O3)로서
담청색을 띄며, 특유의 비릿한 냄새가 있어 후각으로도 판별할 수 있다.
1.2 세개의 산소원자 중 제3의 산소원자는 결합이 약해 쉽게 분리되어
발생기 산소(Oㆍ)로 되며, 이 발생기 산소는 강력한 산화력을 지니고 있다.
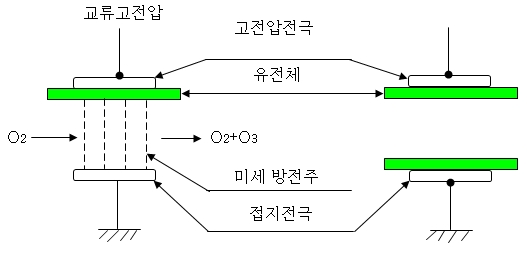
2. 오존의 발생원리
상대하는 전극 간에 유전체(誘電體)를 설치하고, 전극에 교류의 고전압을 흐르게
하면 전극 간에 무성방전이 지속적으로 일어난다.
그 무성방전의 전장(電場)에 건조한 공기나 산소를 통과시키면, 방전에 따른
가속전자가 산소분자의 일부를 산소원자로 분리한다.
그 산소 원자가 다른 산소분자와 결합(반응)하여 오존이 발생된다.
3. 오존 처리의 특징
자연계에서는 불소 다음로 강력한 산화력을 지니며 (염소의 5~10배)
대부분의 유해물질을 상온ㆍ대기압에서 산화ㆍ분해하고,
살균ㆍ탈색ㆍ탈취 작용을 한다.
오존은 최종적으로 산소로 환원하여, 유해한 산화물을 남기지 않으므로 2차 오염이
없다.
공기(산소)와 전기를 원료로 하여 어디에서나 쉽게 발생 시킬 수 있다.
4. 오존의 반응
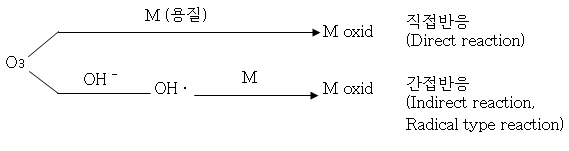
1) 산화반응
① 직접반응 : 오존 자신이 오염물질과 직접 반응하는 현상
② 간접반응 : 오존이 Hydroxyl ion ( OH- : 수산기 이온)과 반응하여
Hydroxyl radical (OHㆍ 수산기 레디컬)로 변환된 후
그 레디컬 (radical)의 반응으로 산화ㆍ분해 시키는 현상
 <액상에서 오존의
반응 경로>
대부분의 용수에서는 우선적으로 직접반응을 하지만, 난산화성 물질이 있는 경우,
radical 반응인 간접반응으로 산화ㆍ분해된다.
OH radical 반응을 활성화 시키기 위해서, 과산화수소 (H2O2)나 자외선 (UㆍV)을
반응 촉진물질로 병용한다.
|







